დუშენის კუნთოვანი დისტროფიის მკურნალობის თანამედროვე გენეტიკური მეთოდები
ქრომოსომებზე გენთა ლოკალიზაციის ადგილი და ის მუტაციები, რომლებიც სხვადასხვა დაავადებას, მათ შორის - ნერვულ-კუნთოვან დაავადებებს, იწვევს.
ნერვულ-კუნთოვანი დაავადებების ჯგუფი 100-ზე მეტ დაავადებას მოიცავს, რომელთაგან ზოგიერთი დაბადებისთანავე ან ადრეულ ბავშვობაში ვლინდება, ზოგიერთის პირველი სიმპტომი კი ზრდასრულ ასაკში იჩენს თავს. მათ შორის ბევრია მემკვიდრეობითი ბუნებისა. მათ ერთი ოჯახის წევრებს შორისაც სხვადასხვა გამოვლინება ახასიათებთ.
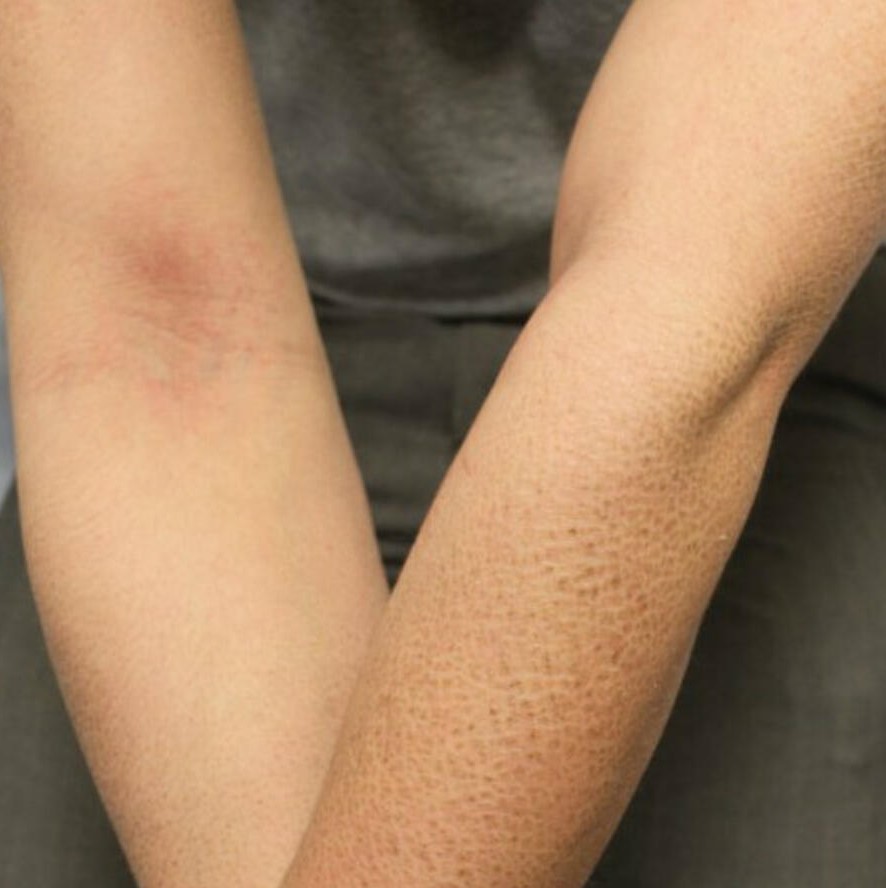
დუშენის კუნთოვანი დისტროფია ერთ-ერთი ყველაზე გავრცელებული მემკვიდრეობითი დაავადებაა, რომელიც ჩონჩხის კუნთების ბოჭკოებს აზიანებს. ის 10 000 ახალშობილი ვაჟიდან 3-ს აღერიცხება. ვლინდება სიცოცხლის პირველივე წელს. ბავშვი გვიან იწყებს სიარულს, არ შეუძლია სირბილი, ხტომა. მოგვიანებით უვითარდება წელის ლორდოზი, უჭირს კიბეზე ასვლა, ხშირად ეცემა.
/* (c)AdOcean 2003-2021, Advertline.https:mkurnali.ge.mkurnali zones.________ _____ */
ado.slave('adoceanadvertlinegelpmmhkfobb', {myMaster: 'gC_g7BxQlx9UWDeCK7yaEdkgIoxg2l6o6JUmNs2rvgn.i7' });
გარეგნულად კუნთი ზომაზე დიდია, რადგან კუნთოვანი ქსოვილი ატროფირებულია და შემაერთებელი და ცხიმოვანი ქსოვილით არის ჩანაცვლებული. ზიანდება გულის კუნთი, კუჭ-ნაწლავის ტრაქტის მოტორული ფუნქცია. კუნთთა ატროფიის უკანასკნელ სტადიაზე ზიანდება სახის, საყლაპავისა და სასუნთქი კუნთები, რაც 20-30 წლის ასაკში პაციენტის სიკვდილს იწვევს.
დუშენის კუნთოვანი დისტროფია სქესთან შეჭიდული რეცესიული დაავადებაა. ეს იმას ნიშნავს, რომ იგი მემკვიდრეობს სასქესო X ქრომოსომასთან ერთად. დადგენილია, რომ ამ დაავადების სამიდან 2 შემთხვევაში დაზიანებული გენი ვაჟებს დედისაგან ერგოთ. დედა ამ გენის მატარებელია, გენის რეცესიული ბუნების გამო მას დაავადების არავითარი ნიშანი არ უვლინდება. დაზიანებული გენის მატარებელი დედის ოთხი ვაჟიდან მხოლოდ ერთს აქვს ალბათობა იმისა, რომ დედისაგან დაზიანებულ გენს მიიღებს და დაავადდება, ხოლო ოთხიდან ერთ გოგონას - ალბათობა იმისა, რომ დაზიანებული გენის მატარებელი იქნება და ამ გენს თავის ვაჟს გადასცემს. დანარჩენი ბავშვები, გოგონებიც და ვაჟებიც, ნორმალური გენის მატარებლები იქნებიან.
დუშენის კუნთოვანი დისტროფიის მიზეზი ცილა დისტროფინის დეფექტია. ამ ცილას გენი DMD ასინთეზებს. დისტროფინი მოთავსებულია კუნთოვანი უჯრედის გარსთან ახლოს და უჯრედის გარსის მთლიანობას უზრუნველყოფს. დისტროფინის დარღვევები იწვევს ციტოპლაზმური კომპონენტების დეგენერაციას და მიოფიბრილათა სიკვდილს.
მიოფიბრილები კუნთოვან უჯრედში მოთავსებული ცილინდრული ძაფებია, რომლებიც კუნთოვანი უჯრედის ერთი ბოლოდან მეორემდეა გაჭიმული. სწორედ მიოფიბრილებს შესწევთ უნარი შეიკუმშონ და კუნთსაც მიანიჭონ შეკუმშვა-მოდუნების ანუ მოძრაობის უნარი.
დისტროფინის გენი ერთ-ერთი ყველაზე მრავალნუკლეოტიდიანი გენია - 2 მილიონამდე ნუკლეოტიდს შეიცავს. დნმ-ანალიზი, რომელსაც დიაგნოზის დასაზუსტებლად მიმართავენ, გვიჩვენებს, რომ პაციენტთა 2/3-ს ამ გენის დასაწყისში ან შუაში მოთავსებული უბნები აქვს დაკარგული.
აღსანიშნავია ისიც, რომ დაავადების სიმძიმე არ არის დამოკიდებული დაკარგული (დელეცირებული) უბნის ზომაზე. მუტაციათა ტიპებიდან გვხვდება გენის უბანთა გაორმაგება – დუბლიკაცია და წერტილოვანი მუტაციები.
დუშენისა და სხვა კუნთოვანი დისტროფიების მკურნალობის თანამედროვე მეთოდთა ძიება დღეს რამდენიმე მიმართულებით მიმდინარეობს. მეცნიერები ცდილობენ, დაგროვილი თეორიული ცოდნა მიუსადაგონ მკურნალობის თანამედროვე გენეტიკურ მეთოდთა შესაძლებლობებს და ან სრულ განკურნებას მიაღწიონ, ან დაავადების მიმდინარეობა შეამსუბუქონ.
მკურნალობის ერთ-ერთ პრიორიტეტულ მეთოდად მიიჩნევა გენური თერაპია. მისი მიზანია კუნთოვან უჯრედებში დაზიანებული, დეფექტური დისტროფინის გენის ჩანაცვლება ნორმალური გენით და დისტროფინის ნორმალური მოლეკულის სინთეზის აღდგენა. ამ მიზნის მისაღწევად მკვლევარებს არაერთი სირთულის დაძლევა მოუხდათ. მათ შექმნეს ადენოვირუსთა სხვადასხვა ვარიანტი, რომელთაც შეუძლიათ ნორმალური გენის გადატანა კუნთოვანი უჯრედების შიგნით. მაგრამ კუნთები მილიარდობით უჯრედისგან შედგება, სამკურნალო ეფექტის მისაღებად კი კუნთოვანი უჯრედების 20%-მა მაინც უნდა მიიღოს ჩანერგილი გენი. გარდა ამისა, დისტროფინის გენი ძალიან დიდია - 500-ჯერ აღემატება ვირუსის გენომს, ამიტომ ადენოვირუსში "არ ეტევა".
მრავალწლიანი სამეცნიერო მუშაობის შედეგად მეცნიერებმა შექმნეს დისტროფინის ნორმალური გენის მინიასლი, რომელსაც ყველა ფუნქცია შენარჩუნებული აქვს, მინიდისტროფინი ვირუსში ჩანერგეს და დაიწყეს კლინიკური გამოცდები. პირველი კლინიკური გამოცდა გენოთერაპიის გამოყენებით ჯერ კიდევ 1999 წელს ოჰაიოს უნივერსიტეტში ჩატარდა: ნორმალური მინიდისტროფინის გენი გადანერგილ იქნა მიოპათიის ერთ-ერთი სახით დაავადებული პაციენტის კუნთებში. მის ტერფის კუნთში ინექციით ჩანერგილ იქნა მილიარდი ჯანმრთელი გენის ასლი.
სამწუხაროდ, 1999 წელს დაავადებათა მკურნალობაში გენური თერაპიის მეთოდის გამოყენებით მიმდინარე სხვა ექსპერიმენტისას პენსილვანიის შტატის უნივერსიტეტში პაციენტი გარდაიცვალა და ამ ტრაგიკული შემთხვევის შემდეგ გენური თერაპიის მეთოდების გამოყენებით მკურნალობა დროებით შეჩერებულ იქნა. მუშაობა მხოლოდ 2002 წელს განახლდა.
კლინიკურმა გამოცდებმა ცხადყო, რომ ადენოვირუსი იმუნურ რეაქციებს იწვევს და იგი ნადგურდება იმუნური სისტემის მიერ. ჯერჯერობით არ არსებობს არავითარი გზა, რომ იმუნური სისტემა ვირუსის უვნებლობაში „დავარწმუნოთ". ამიტომ ერთადერთი გზაა, შევასუსტოთ იმუნური რეაქცია სპეციფიკური იმუნოდეპრესანტებით ან შევარჩიოთ სხვა ვირუსი.
ჩრდილოეთ კაროლინის უნივერსიტეტში პროფესორ რ. სამულსკის ხელმძღვანელობით 2006 წელს დაიწყო და 2010 წელს დასრულდა ცდები მკურნალობის არსენალში გენური თერაპიის მეთოდის გამოყენების შესაძლებლობათა შესასწავლად. კლინიკურ გამოცდაში მონაწილეობდა დუშენის მიოპათიის მქონე ექვსი პაციენტი. ამჟამად შედეგები დამუშავების პროცესშია.
დაავადების მკურნალობის გზების ძიების მეორე მიმართულებას საფუძველი მას შემდეგ ჩაეყარა, რაც ოქსფორდის უნივერსიტეტის პროფესორმა ქეი დევისმა ცილა უტროფინი აღმოაჩინა. ცილა უტროფინი სტრუქტურული აგებულებით ძალიან ახლოს დგას დისტროფინთან - მათი მოლეკულები 80%-ით იდენტურია. უტროფინის სინთეზზე პასუხისმგებელია გენი, რომელიც მე-6 ქრომოსომაზეა მოთავსებული და არა სასქესო X ქრომოსომაზე. დუშენის კუნთოვანი დისტროფიის დროს უტროფინის გენი არ ზიანდება. ემბრიონული განვითარების პერიოდში უტროფინი სინთეზირდება ყველა კუნთოვან ქსოვილში.