ციფრული ონკოლოგია
განვითარებამ დიდი შესაძლებლობები შეუქმნა ექიმ-სპეციალისტებს ცალკეული სიმსივნური დაავადებების თერაპიასა და მართვაში; რაც მთავარია, რადიკალურად განსხვავებული შედეგები მოუტანა ონკოპაციენტებს.
ფაქტია, რომ ციფრული ონკოლოგია, როგორც მომავლის მედიცინა, სულ უფრო ფართოდ შლის ფრთებს. მიუხედავად იმისა, რომ ბევრი ქვეყნისთვის (მათ შორის – საქართველოსთვის) ის ჯერ უცხო ხილი და ფუფუნებაა, დიაგნოსტიკის სრულყოფილებითა და მკურნალობის პერსონალიზებული მიდგომებით დიდ პერსპექტივასა და იმედს უსახავს ონკოპაციენტებს.
სწორედ ციფრული ონკოლოგიის საინტერესო და აქტუალურ საკითხებზე გვესაუბრება ჩვენი თანამემამულე (თბილისში დაბადებული და გაზრდილი), ქ. მოსკოვის ი. მ. სეჩენოვის სახ. I სამედიცინო უნივერსიტეტის პერსონალიზებული ონკოლოგიის დეპარტამენტის წამყვანი სპეციალისტი (კლინიცისტი-მკვლევარი), ქ. თბილისის სამედიცინო ცენტრ „Medi-მედი“-ს კლინიკური ონკოლოგი-კონსულტანტი – ალექსანდრე ბოროდა.
ბატონი ალექსანდრე ახალგაზრდა, მაგრამ დიდი გამოცდილების მქონე სპეციალისტია. მას 19-წლიანი გამოცდილება აქვს ონკოლოგიაში, არაერთი საერთაშორისო კლინიკური და ეპიდემიოლოგიური კვლევის მონაწილეა.
სტაჟირება და თანამშრომლობა: ონკოლოგიის ევროპული სკოლა (European School ofOncology), მილანო (იტალია), ბელინზონა (შვეიცარია); კიბოს კვლევის საერთაშორისო სააგენტო (IARC), ლიონი (საფრანგეთი); ოქსფორდის უნივერსიტეტი (დიდი ბრიტანეთი).
პუბლიკაციები წამყვან საერთაშორისო სამეცნიერო ჟურნალებში მაღალი იმპაქტფაქტორით, როგორებიც არის: „The Lancet“, „International Journal ofEpidemiology“, „Frontiers in Oncology“ და სხვა.
ალექსანდრე ბოროდა მფლობელია პატენტისა სამედიცინო გამოგონებისთვის კიბოს ეპიდემიოლოგიური კვლევების სფეროში – N2695500, 23.07.2019.
მისი მოღვაწეობის არეალია: კიბოს დიაგნოსტიკისა და მკურნალობის თანამედროვე მეთოდები, პერსონალიზებული ონკოლოგია, ონკოლოგიური სკრინინგი, ციფრული ონკოლოგია.
– ბატონო ალექსანდრე, რას გვეტყვით ციფრულ მედიცინასა და ციფრულ ონკოლოგიაზე, როგორია ამ სფეროთა შესაძლებლობები და სამომავლო პერსპექტივები?
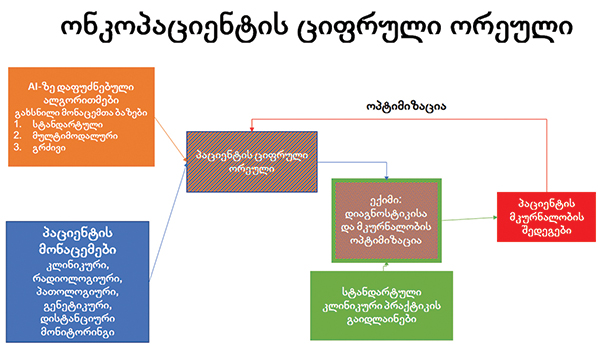
– ციფრული ონკოლოგია, პრაქტიკულად, ციფრული მედიცინის ანუ ციფრული ჯანდაცვის ნაწილია. ეს უკანასკნელი წარმოადგენს თანამედროვე მედიცინის მულტიდისციპლინურ მიდგომას, რომელშიც ჩართულია მრავალი დაინტერესებული მხარე (stakeholders): კლინიკური და კვლევითი მედიცინის სპეციალისტები, საზოგადოებრივი ჯანდაცვის, სოციალურ-ეკონომიკური, საინჟინრო მეცნიერებების, გამოთვლითი ტექნიკის, ტელეკომუნიკაციების ექსპერტები.
ყველაზე ხშირად ციფრული მედიცინა ასოცირდება ელექტრონულ ჯანდაცვასა და ტელემედიცინასთან. სინამდვილეში, ეს არის ციფრული მედიცინის მხოლოდ ცალკეული ელემენტები. ციფრული მედიცინის დახმარებით მნიშვნელოვნად იზრდება სამედიცინო მომსახურების ორგანიზების ეფექტურობა. ეს, თავის მხრივ, დიდი რაოდენობის სამედიცინო მონაცემების დამუშავებისა და ანალიზის შედეგების ციფრული ფორმით გამოყენების ხარჯზე მიიღწევა.
სადღეისოდ ექსპერტები გამოყოფენ ციფრული ჯანდაცვის განვითარების რამდენიმე ყველაზე მნიშვნელოვან და პერსპექტიულ მიმართულებას:
- სამედიცინო მომსახურების პროცესების ორგანიზება ექიმთან ვიზიტისთვის ჩაწერიდან ტელემედიცინამდე და სამედიცინო მონაცემების შენახვამდე;
- ბლოკჩეინის გამოყენება პერსონალური სამედიცინო მონაცემების უსაფრთხოებისთვის;
- ხელოვნური ინტელექტი, როგორც ასისტენტი/ექსპერტი დიაგნოსტიკაში, პროგნოსტიკასა და მკურნალობა/პროფილაქტიკური ღონისძიებების შერჩევაში;
- ვირტუალური და დამატებითი რეალობა, როგორც სამედიცინო დახმარების ერთ-ერთი ინსტრუმენტი;
- ტარებადი მოწყობილობები, როგორც პაციენტის აქტიური ჩართულობა – მონაწილეობის საფუძველი და ჯანდაცვის სფეროში პრევენციული მიმართულების გაძლიერება-განვითარების შესაძლებლობა.
– ციფრულ სისტემებზე გადასვლამ მართლაც დიდი გარდატეხა შეიტანა მედიცინაში...
– ჯანდაცვის ციფრული ტრანსფორმაცია განუყოფლად არის დაკავშირებული სხვა გლობალურ ტრენდებთან, ტრადიციული ჯანდაცვისა და სამედიცინო მომსახურების სისტემიდან მომავლის მედიცინის კონცეფციაზე გადასვლის კვალად.
21-ე საუკუნის მედიცინის ეს კონცეფცია „4 P“ მედიცინის სახით (Predictive, Preventive, Personalized, Participative, შესაბამისად – პროგნოზირებადი, პრევენციული, პერსონალიზებული, მონაწილეობითი) ჩამოაყალიბა ადამიანის გენომის გაშიფვრის ერთ-ერთმა პიონერმა, ამერიკელმა ბიოლოგმა ლეროი ჰუდმა (Leroy Hood).
ამ კონცეფციის მიხედვით, 21-ე საუკუნის მედიცინა უნდა იყოს:
- პროგნოზირებადი – ანუ უნდა იძლეოდეს დაავადების პროგნოზირების საშუალებას გენომისა და კონსტიტუციის ინდივიდუალური მახასიათებლების საფუძველზე;
- პრევენციული – უნდა მოქმედებდეს წინსწრებით, ანუ შეეძლოს დაავადების განვითარების არიდება;
- პერსონალიზებული – უნდა იყენებდეს ინდივიდუალურ მიდგომას თითოეული ადამიანის მიმართ;
- მონაწილეობითი – (იგივე ჩართულობითი), უნდა ეფუძნებოდეს ექიმებისა და პაციენტების აქტიურ თანამშრომლობას, ასევე სხვადასხვა სპეციალისტის ურთიერთთანამშრომლობას პრევენციის, მონიტორინგის, რეაბილიტაციის სტრატეგიის მისაღწევად. მნიშვნელოვანია ასევე პაციენტის პასუხისმგებლობა საკუთარ ჯანმრთელობაზე.
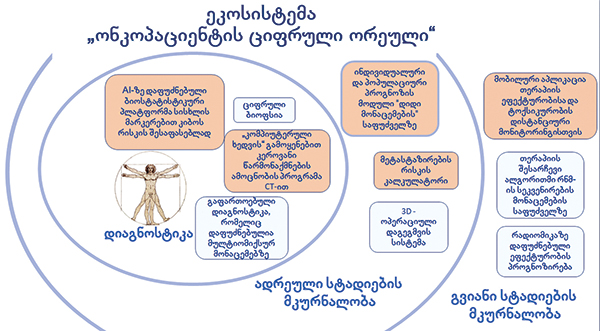
ციფრული ონკოლოგიის სფეროთა (მიმართულებათა) მაგალითებია:
- Digital Display Precision Predictor (ციფრული პრედიქტორი) – ეს არის ალგორითმი, შემუშავებული WIN (Worldwide Innovative Networking in personalized cancer medicine) კონსორციუმის წევრების, მათ შორის, სეჩენოვის უნივერსიტეტისა და სხვა ინსტიტუტების მეცნიერთა მიერ, დაფუძნებული ხელოვნური ინტელექტისა და მანქანათმცოდნეობის ტექნოლოგიებზე. ეს ალგორითმი გამოიყენება პაციენტის გადარჩენის, სიცოცხლის ხანგრძლივობის პროგნოზირებისთვის დაავადების პროგრესირების გარეშე თარგეტული (მიზნობრივი) თერაპიის დროს, რომელიც, თავის მხრივ, ეფუძნება მთლიანი ტრანსკრიპტომის სიღრმისეულ კვლევას, განსხვავებით არსებული ორეული პროგნოზირებადი ბიომარკერებისგან, რომელთაც შეუძლიათ იწინასწარმეტყველონ, მოახდენენ თუ არა პაციენტები კონკრეტულ თერაპიულ რეჟიმზე რეაგირებას (ტრანსკრიპტომი არის ამა თუ იმ უჯრედის დნმ-დან ინფორმაციის წაკითხვისას სინთეზირებული რნმ-ების ერთობლიობა).
მაგალითად, ასეთ მიდგომას შეუძლია გამოავლინოს რეციდივის მაღალი რისკის ჯგუფი ფილტვის კიბოს I და II სტადიის მქონე პაციენტებს შორის, რომლებსაც შეეძლოთ სარგებელი მიეღოთ ადიუვანტური მიზნობრივი თერაპიისგან, ისეთი ძლიერი სამიზნეების წინააღმდეგ, როგორებიც არის EGFR-გენის მუტაციები ან ALK-გენის რეარანჟირება.
(ადიუვანტურ თერაპიას ონკოლოგიაში უწოდებენ ისეთ თერაპიას, რომელიც ინიშნება ძირითადი მკურნალობის, უხშირესად ოპერაციის, ან იშვიათად სხივური თერაპიის შემდეგ).
- Digital Twin – ციფრული ორეული – სეჩენოვის უნივერსიტეტის პროექტი დიდი მონაცემების (Big Data) ანალიზის ტექნოლოგიური პლატფორმის შესაქმნელად, რათა შეიქმნას დაავადებების ციფრული ორეულები ანუ ვირტუალური პაციენტები. კომპიუტერული მოდელირების საშუალებით ექიმებს შეეძლებათ ონკოლოგიური დაავადებების შესწავლა, მათი მიმდინარეობის პროგნოზირება და ასევე ინდივიდუალური და ყველაზე ეფექტური თერაპიის შერჩევა. ამისთვის ციფრული ორეულის (ტყუპის) დახმარებით იქმნება ორგანიზმისა და შესაბამისი სამკურნალო აგენტის ურთიერთქმედების პროცესის სიმულაცია. მაგალითად, ციფრული ორეულის ერთი ასპექტი არის 3D ქირურგიული დაგეგმვის სისტემა ხელოვნური ინტელექტის დახმარებით. სისტემა ნეირონული ქსელის დახმარებით ქმნის სიმსივნის, დაზიანებული ორგანოსა და მიმდებარე სტრუქტურების სამგანზომილებიან გამოსახულებას, შემდგომ ოპერაციათა დაგეგმარების შესაძლებლობით. ამჟამად გამოყენებული მეთოდები ნერვული ქსელების გამოყენების გარეშე 3D მოდელების შესაქმნელად მოითხოვს დიდ დროს და სერიოზულ უნარებს, რაც აძნელებს მათ ფართო გამოყენებას რეალურ კლინიკურ პრაქტიკაში. შედეგად, მიღებული მოდელი ამ სამუშაოს აჩქარებს რამდენიმე წუთამდე ერთეულ კლინიკურ შემთხვევაში.
– დღეს განსაკუთრებული ყურადღება ეთმობა პაციენტთა პერსონალიზებულ მიდგომას. რა უპირატესობა აქვს პერსონალიზებულ ონკოლოგიას, რით არის ის გამორჩეული?
– ამჟამად პერსონალიზებული მიდგომა სულ უფრო ფართო გავრცელებას პოვებს ონკოლოგიურ პრაქტიკაში. ბოლო ათწლეულის განმავლობაში მნიშვნელოვანი წარმატებები იქნა მიღწეული ონკოლოგიაში ბიომარკერების შემუშავების სფეროში. როგორც მოგეხსენებათ, ბიომარკერები მნიშვნელოვან როლს ასრულებენ იმ მოლეკულური და უჯრედული მექანიზმების შეცნობაში, რომლებიც საფუძვლად უდევს სიმსივნის აღმოცენებას, განვითარებასა და პროგრესირებას. ამ აღმოჩენებმა ხელი შეუწყო ახალი სამკურნალო მიზნებისა და სტრატეგიების შემუშავებას. დაგვიანებული სტადიის კიბოს მქონე პაციენტთა მკურნალობის სტანდარტმა ემპირიული სტრატეგიიდან (რომელიც ეფუძნება კლინიკოპათოლოგიურ პროფილს) გადაინაცვლა სრულიად ახალ სტრატეგიაზე, რომელშიც გამოყენებულია სიმსივნის მოლეკულურ პროფილსა და ბიომარკერებზე დაფუძნებული სამკურნალო ალგორითმი.
მულტიპლექსური გენოტიპირებისა და გენომის პროფილირების (მომდევნო თაობის სეკვენირების მეშვეობით) ტექნოლოგიების სფეროში მიღებული უახლესი მიღწევები კიბოს გენომის სწრაფი და მრავალმხრივი ანალიზის საშუალებას ქმნის ცალკეულ პაციენტებთან, თუნდაც სიმსივნის ძალიან მცირე ბიოფსიური მასალიდან. კლინიკურ პრაქტიკაში მიზნობრივი (თარგეტული) თერაპიის დანერგვამ მნიშვნელოვნად გააუმჯობესა პაციენტთა მკურნალობის შედეგად ცხოვრების დამაკმაყოფილებელი ხარისხი. მიზნობრივი თერაპიის მაღალი ღირებულების გათვალისწინებით ძალზე მნიშვნელოვანია თერაპიაზე საპასუხო გენეტიკური პრედიქტორების (გენეტიკური პროგნოზირების) გამოვლენა და დანერგვა პრაქტიკაში. ასე აღმოაჩინეს გენეტიკური მარკერი, კერძოდ, KRAS გენის მუტაცია, რომლის არსებობა იწვევს კოლორექტალური კიბოს დანიშნულ მკურნალობაზე რეაგირების (პასუხის) არარსებობას.
– გამოდის, რომ ციფრული ონკოლოგიის დახმარებით დღეს უკვე შესაძლებელია იმ გენების გამოვლენა, რომელთა ექსპრესიის პირობებში დანიშნული ქიმიოთერაპია შესაძლოა არაეფექტური გამოდგეს. შესაბამისად, გენოტიპირებისა და გენომის პროფილირების ტექნოლოგიებზე დაყრდნობით ონკოლოგს შეუძლია იმის განსაზღვრა და პროგნოზირება, რომელი თერაპიული სქემა მოუტანს შედეგს და ასე ვთქვათ, წაადგება პაციენტს...
– სწორედ ესაა საქმე! მე-3-4 სტადიის ავთვისებიანი სიმსივნეების მქონე პაციენტებისთვის თერაპიის სტანდარტული, არაპერსონალიზებული მიდგომით დანიშვნისას პასუხის (საპასუხო რეაგირების) ალბათობა არ აღემატება საშუალოდ 25-30%-ს. ამასთან, გამოყენებული თერაპიის ეფექტურობის შეფასება შესაძლებელია მხოლოდ მკურნალობიდან 2-3 თვის შემდეგ. ამიტომაც პაციენტები, რომლებიც არ პასუხობენ თერაპიას (არარესპონდერები, არამოპასუხენი), კარგავენ ძვირფას დროს.
მაგალითისათვის შემიძლია მოგიყვანოთ ერთი პაციენტის შემთხვევა. 48 წლის პაციენტმა, რომელსაც ჰქონდა ALK-დადებითი ფილტვის კიბოს დიაგნოზი (სტადია-2) (კლინიკურად მართავდნენ დიაგნოზიდან 6.5 წლის განმავლობაში), სიმსივნე ამოიკვეთა ქირურგიულად, მაგრამ 8 თვის შემდეგ აღმოაჩნდა ტვინის მრავალი მეტასტაზი. პაციენტმა დაიწყო პლატინაზე დაფუძნებული ქიმიოთერაპიის მიღება და შემდეგ ჩაირიცხა მეორე თაობის ALK ინჰიბიტორის ცერიტინიბის კლინიკურ კვლევაში, რამაც გამოიწვია სტაბილიზაცია 21 თვის განმავლობაში. დაავადების რეციდივის შემდეგ პაციენტი წარმატებით იმართებოდა 33 თვის განმავლობაში ქიმიო- და ადგილობრივი აბლაციური თერაპიის სხვადასხვა ხაზით. ქიმიოთერაპიული რეჟიმები, მათ შორის, კრიზოტინიბი + ბევაციზუმაბი + დოცეტაქსელი, შერჩეული იყო კიბოს ტრანსკრიპტომის მონაცემების საფუძველზე მართული ბიოინფორმაციული გადაწყვეტილების მხარდაჭერის სისტემის (Oncobox) გამოყენებით. ამ თერაპიამ გამოიწვია დამატებითი სტაბილიზაცია 22 თვის განმავლობაში. ჩვენი პაციენტის გადარჩენა ALK ინჰიბიტორის მიმართ რეზისტენტობის განვითარების შემდეგ უფრო ხანგრძლივი იყო, 16 თვის განმავლობაში, ვიდრე ადრე მოხსენიებული სიცოცხლის საშუალო ხანგრძლივობა.
ეს შემთხვევა აჩვენებს, რომ მიზნობრივი თერაპიის ტრანსკრიპტომით მართული თანმიმდევრული პერსონალიზებული დანიშნულება შეიძლება იყოს უფრო ეფექტური ავადმყოფის გადარჩენისა და მისი ცხოვრების ხარისხის თვალსაზრისით ALK – მუტირებული ფილტვის კიბოს შემთხვევაში.
მარკერებზე ტესტირება ხელს უწყობს არასაჭირო და არაეფექტური თერაპიის თავიდან აცილებას, ასევე მკურნალობის ჯანდაცვის ხარჯების ოპტიმიზაციას. აქედან გამომდინარე, ონკოლოგიაში სამკურნალო თერაპიის პრიორიტეტული ამოცანაა ასეთი მარკერების დიაპაზონის გაფართოება და კლინიკურ პრაქტიკაში მათი გამოყენების შეფასება.